Du ronflement au syndrome des apnées obstructives du sommeil
Dans le cas d'une personne souffrant de ronflement ou d'apnée obstructive du sommeil, c'est tout au plus son/sa partenaire qui observe le dormeur, et certainement pas le médecin traitant. Et le spécialiste consulté n'examine le patient souffrant de troubles du sommeil qu'à l'état de veille. Ce qui pourrait être l'une des raisons pour lesquelles les troubles respiratoires pendant le sommeil n'ont été découverts que tardivement. C'est Guilleminault qui a décrit pour la première fois en 1973 le syndrome des apnées obstructives du sommeil (SAOS). Il a fallu encore quelques années pour en avoir un traitement efficace [1]. Le "marché de la santé" se trouve aujourd'hui en face d'une industrie en plein boom, qui améliore constamment les techniques de diagnostic et de traitement. Quelque 3% de la population adulte (et même sensiblement plus dans quelques études) souffrent d'un trouble respiratoire pendant le sommeil [2]. La proportion homme:femme est de 2:1 et s'équilibre après la ménopause.
Le syndrome des apnées obstructives du sommeil se rencontre également chez l'enfant. Des végétations volumineuses en sont la plupart du temps la cause. Il faut y penser chez un enfant qui ronfle la nuit ou qui présente même une dyspnée évidente. Nous ne connaissons pas les chiffres exacts de son incidence.
Examen clinique

Il y a toute une série de variantes entre le ronflement banal, régulier, et le SAOS grave [3]. Et le simple ronfleur ne finira pas forcément par devenir un grave apnéique du sommeil.Le SAOS se caractérise par un ronflement très irrégulier, avec pauses respiratoires. Ces deux symptômes sont souvent remarqués par la/le partenaire.
Les pauses respiratoires provoquent des réactions d'éveil (arousals). Elles peuvent être très fréquentes et modifier à long terme l'architecture du sommeil, ce qui est l'une des principales caractéristiques du diagnostic polysomnographique. Le patient souffre d'une somnolence diurne, avec tendance à l'endormissement dans toutes sortes de situations (tableau 1).
Etiologie
Le SAOS présente une incidence familiale. Les facteurs de risque sont: le sexe masculin, la ménopause, l'obésité, la consommation exagérée d'alcool et de médicaments. La cause des pauses respiratoires est une obstruction totale et passagère des voies respiratoires hautes, pharyngées, sous l'effet probablement d'une instabilité anatomique génétiquement acquise. Cette instabilité impose une activité neuromusculaire compensatoire qui est abolie pendant le sommeil, ce qui pourrait expliquer le collapsus pharyngé [4].
Physiopathologie
La cause de ce problème est l'obstruction des voies respiratoires hautes, qui déclenche une pause respiratoire. Cette dernière est suivie d'une réaction d'éveil (arousal). La durée de la pause respiratoire dépend de la gravité du SAOS et de la durée de l'existence de ce syndrome. Les patients jeunes ont en général des pauses respiratoires très courtes, qui ne font pratiquement pas baisser l'HbO2, alors que les patients souffrant depuis longtemps de cette maladie ont des pauses respiratoires de plus en plus prolongées, qui entraînent une désaturation sévère d'oxygène. La pause respiratoire est la cause de la réaction d'éveil et de la désaturation. Les réactions d'éveil perturbant sérieusement l'architecture du sommeil sont donc les principales responsables des problèmes des patients. Les désaturations sont secondaires, et si le syndrome des apnées du sommeil dure depuis un certain temps, elles peuvent abaisser la vigilance et les performances intellectuelles, surtout si la saturation d'oxygène est basse de jour également. Le sommeil de mauvaise qualité porte atteinte à la santé. Les désaturations d'oxygène peuvent donc secondairement être à l'origine de problèmes cardiovasculaires [5] (fig. 1).
Figure 1.Complications du SAOS.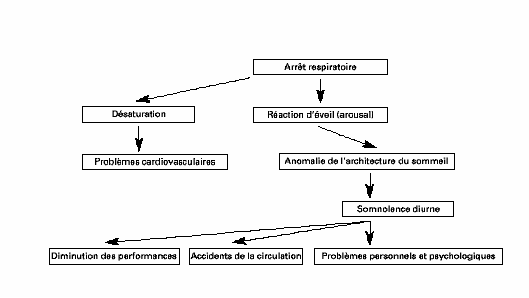
Ronflement obstructif
Le ronflement obstructif est la forme la plus légère d'une pathologie sur augmentation de la résistance dans les voies respiratoires hautes Contrairement au ronflement régulier, fréquemment bénin, la résistance dans les voies respiratoires hautes augmente considérablement dans le ronflement obstructif, et peut déjà déclencher des réactions d'éveil. Un syndrome décrit par Guilleminault, l'Upper Airways Resistance Syndrome (UARS) est défini par un ronflement obstructif avec réactions d'éveil fréquentes, qui ne provoquent toutefois pas de désaturation mais perturbent à long terme l'architecture du sommeil. Les conséquences sont les mêmes que pour le SAOS [6]. Il existe sans doute des formes transitoires entre le ronflement obstructif et l'apnée obstructive du sommeil grave, et il est souvent difficile de définir exactement ces précurseurs du SAOS sans diagnostic technique compliqué (par ex. mesure de la pression intra thoracique pendant le sommeil). Un UARS ne doit pas nécessairement évoluer vers un SAOS [3].
Syndrome des apnées obstructives du sommeil
Le SAOS se caractérise par un ronflement irrégulier, parfois explosif, avec bruit respiratoire irrégulier, pauses respiratoires de plus de 10 secondes et fréquentes réactions d'éveil. Les maladies accompagnées d'une obstruction des voies respiratoires hautes présentent les mêmes symptômes cliniques, dont somnolence diurne, difficultés de concentration, dépression, baisse des performances intellectuelles, dysfonction sexuelle et isolement social. Plus l'architecture du sommeil est perturbée, plus la symptomatologie diurne est marquée, en règle générale.
Cas particuliers
Syndrome d'overlap
Le syndrome d'overlap est l'association d'un SAOS et d'une broncho-pneumopathie obstructive. La captation d'oxygène est significativement diminuée la nuit chez les patients souffrant d'une broncho-pneumopathie obstructive. Chez ces patients, les pauses respiratoires font que les désaturations sont nettement plus marquées que chez ceux qui n'ont pas d'autre pneumopathie.
Syndrome obésité hypoventilation
L'association d'une hypoventilation centrale dans l'obésité et le SAOS est à l'origine des conséquences physiques et psychiques les plus graves (syndrome de Pickwick), avec perturbation profonde de l'architecture du sommeil et désaturations d'oxygène nocturnes gravissimes. Ces patients ont besoin d'une surveillance particulièrement intensive, et souvent un appareil à CPAP n'est pas suffisant. Ces patients doivent être ventilés pendant la nuit avec contrôle de la pression ou du volume (ventilation assistée à domicile de nuit) [7].
Complications du SAOS
Problèmes psychosociaux
Lors du diagnostic, les patients ont souvent déjà une anamnèse d'isolement social. Ils se plaignent de problèmes de participation résultant de leur tendance à l'endormissement, qui provoque une décompensation psychique et des dépressions [8].
Problèmes cardiovasculaires
La plupart des patients ayant un SAOS ont une hypertension à prédominance diastolique. Les conséquences à long terme d'un SAOS sont une hypertension artérielle pulmonaire et un cœur pulmonaire [9]. Ils sont plus souvent victimes d'infarctus du myocarde et d'un accident cérébro- vasculaire [5]. Il est recommandé de demander aux patients à risque cardiovasculaire s'ils souffrent d'un SAOS, et d'en confirmer le diagnostic le cas échéant.
Accidents de travail et de circulation
La plupart des pays ne tiennent pas de statistique des accidents de travail et de circulation. Certaines indications tendraient à montrer que les patients souffrant d'un SAOS sont plus souvent victimes d'accidents causés par eux-mêmes, au travail et ailleurs.
Diagnostic
Pulsoxymétrie nocturne
La pulsoxymétrie nocturne consiste à mesurer la saturation en oxygène de l'hémoglobine par un senseur à infrarouges posé sur le doigt ou le lobule de l'oreille. La pulsoxymétrie nocturne ne permet donc pas d'objectiver les pauses respiratoires, mais uniquement les désaturations résultant des pauses respiratoires. Sa sensibilité pour le diagnostic d'un SAOS est donc limitée, et sa spécificité n'est pas non plus idéale, car de nombreuses autres pathologies peuvent provoquer des désaturations nocturnes. Selon la définition internationale actuelle de la désa-turation, la sensibilité et la spécificité atteignent env. 85% si la baisse de la saturation d'oxygène atteint 4% d'une mesure à la suivante (d'autres définitions donnent 3%). Du fait de sa simplicité, la pulsoxymétrie nocturne est une méthode économique, mais elle n'est pas très bien indiquée pour le "case finding" sans anamnèse ni symptômes cliniques complémentaires.
Polygraphie respiratoire
La polygraphie respiratoire comporte au moins 4 paramètres. En plus de la saturation d'oxygène, elle mesure le débit respiratoire. Elle enregistre en plus les ronflements et la position corporelle. Sa sensibilité est d'environ 95%. La polygraphie nocturne est donc très bien indiquée pour le "case finding", et elle est réservée aux spécialistes et aux centres du sommeil (tab.2).
Polysomnographie nocturne
La polysomnographie nocturne est le standard pour poser un diagnostic de tous les troubles du sommeil, et surtout du SAOS. Avec l'enregistrement d'env. 15 paramètres, elle permet de préciser complètement la nature du sommeil: 3 dérivations EEG (2 temporales, 1 occipitale); 5 électrodes; 2 dérivations EOG; 3 dérivations EMG (mandibule, les 2 jambes); ECG; SaO2; flow (3 pôles, ouverture nasale/buccale); excursions respiratoires (thorax/abdomen); microphone pour les ronflements; position du corps; vidéo; pression CPAP). Une marche à suivre pragmatique est recommandée en pratique. La pulsoxymétrie nocturne est largement répandue, il s'agit donc d'un instrument qui a toujours une certaine importance, malgré sa sensibilité et sa spécificité limitées. Les SAOS sévères sont généralement diagnostiqués. Dans les cas cliniquement clairs, la polygraphie respiratoire directe est indiquée, du fait de sa sensibilité et de sa spécificité meilleures. Les cas douteux doivent passer par la polysomnographie pour être correctement examinés
Traitement
Traitement par CPAP
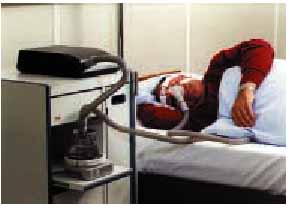
Le standard du traitement du SAOS est le traitement nocturne continu sous pression positive (nCPAP = nasal Continuous Positive Airway Pressure). L'appareil à CPAP donne une rigidité pneumatique des voies respiratoires hautes, qui empêche les pauses respiratoires et permet de restaurer une activité respiratoire régulière normale. La pression optimale peut être déterminée lors d'une polysomnographie ou d'une polygraphie. Ce qui implique qu'une personne doit surveiller le patient pendant toute la nuit. Le dosage automatique de la pression par un appareil auto-CPAP s'est imposé pratiquement partout ces derniers temps. La pression nécessaire est automatiquement déterminée par l'appareil à CPAP, par un algorithme enregistrant en temps utile les variations du débit respiratoire et adaptant la pression de l'air en conséquence [10]. Physio pathologiquement, l'effet de l'appareil à CPAP est facile à comprendre, et le résultat se fait sentir lors de la première ou de la deuxième nuit déjà. Le patient réalise souvent dès la première nuit qu'il a bien dormi, ce qui n'a pas été le cas depuis des années, et il se réveille le lendemain matin bien reposé. Si le diagnostic est soigneusement et bien posé, il est fréquent que le patient enregistre un succès après très peu de temps, ce qui améliore sa compliance [11] .
Traitement chirurgical
Historiquement, la trachéotomie a été la première forme du traitement du SAOS, et c'est aujourd'hui encore la plus efficace. Chez les enfants souffrant d'un SAOS, l'adéno-amygda-lectomie est souvent le traitement de choix. Les opérations plastiques sur le pharynx ne peuvent que réaliser des changements localisés à ce niveau, mais les collapsus sont la plupart du temps présents à différentes localisations, et il est difficile de les situer en ré opératoire. Les méthodes diagnostiques simples se sont avérées être la pharyngoscope transnasale flexible, avec imitation de la pression négative dans le pharynx lors du ronflement (manœuvre de Müller), et la céphalométrie [4]. Certaines opérations peuvent être proposées dans le ronflement et le SAOS discret surtout, alors que seuls quelques rares groupes au monde pratiquent des techniques combinées, dont certaines très compliquées, en cas de SAOS grave (Riley-Powell-Stanford Surgical Protocol). Les interventions les plus courantes sur l'oro- et l'hypopharynx sont l'uvulo-palato-pharyngo-plastie (UPPP) avec plusieurs modifications, la réduction de volume sur le palais mou et la base de la langue par radiofréquence, l'ostéotomie mandibulaire avec transposition antérieure du muscle génioglosse, la myotomie hyoïdienne avec suspension au cartilage thyroïde, et les ostéotomies de transposition sur le maxillaire et la mandibule [13]. Occasionnellement, chez des patients non compliants à la CPAP, des opérations sont indiquées qui visent à élargir les voies respiratoires nasales. L'inconvénient majeur de ces traitements chirurgicaux, en plus de plusieurs complications locales, est que leur résultat est rarement prévisible, en fonction du diagnostic topographique peu sûr. Il est donc recommandé de collaborer avec un habile collègue chirurgien.
Autres méthodes de traitement
Décubitus latéral forcé
Pour des raisons d'ordre anatomique, les obstructions des voies respiratoires hautes sont plus marquées en décubitus dorsal que latéral. C'est pour cela que dans des cas bien choisis, un décubitus latéral forcé peut résoudre le problème. Des poches sont cousues dans le dos d'un T-shirt, dans lesquelles des balles de styropor de moyenne grandeur sont enfilées. Ce T-shirt empêche le patient de se tourner sur le dos et le force à dormir en décubitus plus physiologique. Dans un SAOS dépendant du décubitus dorsal, le décubitus latéral forcé est une méthode efficace, qui ne pose pas trop de problèmes de compliance.
Orthèse mandibulaire (oral appliance)
Dans un syndrome d'apnées obstructives du sommeil discret, le fait de pousser vers l'avant la mandibule aide souvent à améliorer la respiration. Cela crée davantage d'espace rétro lingual. 2-3 mm déjà peuvent suffire à assurer un débit respiratoire plus libre et à prévenir une obstruction des voies respiratoires hautes. Il existe plusieurs types d'orthèse mandibulaire. Nous demandons en général à une personne de la médecine dentaire d'adapter une bride mandibulaire simple du commerce. Si le patient bénéficie du résultat escompté, il est possible après quelques semaines ou mois que le technicien dentiste et le dentiste adaptent une bride définitive. Les résultats de ces brides mandibulaires sont excellents, pour autant que l'indication soit bien posée [14, 15] (figures 3 et 4).
Figure 3.
Orthèses mandibulaires préfabriquées: en matériau synthétique se ramollissant à la chaleur. Ces orthèses peuvent être adaptées facilement par une personne qualifiée en médecine dentaire.
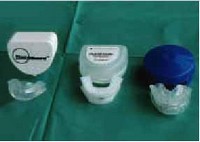
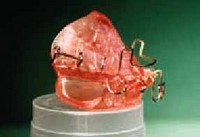
Figure 4.Orthèse mandibulaire Serenox: cette orthèse acrylique est réalisée par un technicien dentiste et a une durée de vie d'environ dix ans.
Médicaments
Il n'existe aucun médicament pour le traitement du SAOS pour le moment. Les premiers essais avec la progestérone n'ont eu aucun résultat, il y a bien des années. Chez les patients dont l'obstruction des voies respiratoires ne se produit que pendant le sommeil REM, donc lorsque la musculature est totalement détendue, il est possible d'essayer des tricycliques ou des inhibiteurs de la recapture de sérotonine (ISRS), qui raccourcissent les phases RME et atténuent du même fait les symptômes. L'effet de ces traitements est cependant limité, et les effets indésirables des tricycliques compromettent la plupart du temps la compliance. Les ISRS n'ont pas encore été très étudiés.
Neurostimulation
Sur la base de la vieille idée que le SAOS pourrait être le fait surtout d'une diminution de l'activité musculaire compensatoire du muscle génioglosse pendant le sommeil, un groupe de travail américain est parvenu pour la première fois récemment à traiter le SAOS pendant plusieurs mois chez un petit collectif, par un stimulateur implanté sur le nerf hypoglosse, déclenché par la respiration. Malgré plusieurs problèmes techniques et l'absence de résultats à long terme, la neurostimulation pourrait être une nouvelle option thérapeutique.
Contrôles
Le traitement par un appareil à CPAP, mais aussi l'orthèse mandibulaire, exigent de la part du patient une bonne compliance. Ce qui comprend également un contrôle rapproché par du personnel dûment formé et des médecins expérimentés. La marche à suivre suivante a fait ses preuves chez les patients sous CPAP :
- Le patient est bien entraîné au centre du sommeil, avant de rentrer à domicile avec un masque bien adapté et son appareil à CPAP. Dans le mois qui suit, contrôle technique à la Ligue pulmonaire cantonale, qui demande au patient de donner son appréciation. Un contrôle chez le spécialiste est également recommandé au cours de ce premier mois.
Un contrôle s'effectue au centre du sommeil après trois mois. Le masque est réadapté, la pression nécessaire de CPAP fixée et le patient est de nouveau formé de manière intensive. Il s'est avéré que cette formation intensive a une importance absolument déterminante pour la compliance ultérieure. Lors de ce contrôle à trois mois, 40% des patients dont la compliance est mauvaise peuvent être motivés à être mieux compliants. Et ensuite des contrôles annuels chez le spécialiste ou au centre du sommeil sont indispensables. Des contrôles réguliers à la Ligue pulmonaire sont également prévus. Le médecin traitant, qui connaît bien son patient, a une importance majeure dans le contrôle clinique. En discutant avec son patient, il peut juger de l'efficacité du traitement, si la somnolence diurne a disparu et si la joie de vivre perdue est retrouvée. Et c'est à son médecin traitant que le patient parlera le plus volontiers de ses problèmes de compliance.
Contrôle de qualité
Les examens par polygraphie respiratoire et polysomnographie sont réservés à des spécialistes ou centres du sommeil reconnus. La polygraphie respiratoire peut être effectuée en ambulatoire par des médecins formés et re-connus, ce qui assure un contrôle de qualité.
Conclusion
Le succès du traitement du SAOS dépend dans une très large mesure d'un diagnostic complet, de la bonne planification et réalisation des éventuels traitements chirurgicaux, de l'adaptation soigneuse des moyens auxiliaires (CPAP, orthèse mandibulaire) et de l'expérience des collaboratrices et collaborateurs dans l'adaptation du masque et la formation du patient. Il faut viser à ce que la compliance du patient soit bonne si les plaintes subjectives tombent rapidement. Les patients qui n'ont aucun problème ont en général une mauvaise compliance, et il faut les traiter et les former spécialement pour les persuader de la nécessité d'un traitement régulier. Le contrôle à trois mois chez le spécialiste est déterminant pour la compliance, car les éventuels problèmes survenus sous traitement (masque, pression, bruit de l'appareil) peuvent être abordés et discutés de manière intensive.
Abréviations:
CPAP (également nCPAP) nasal Continuous Positive Airway Pressure
SAOS Syndrome des apnées obstructives du sommeil
UARS Upper Airway Resistance Syndrome
UPPP Uvulo-palato-pharyngo-plastie
http://www.medicalforum.ch/
Le ronflement, une maladie ?
Par le Dr Emmanuel Schmitt, ORL (Oto-Rhino-Laryngologie), Poissy
Qui dans son entourage n'a pas subi les agressions bruyantes d'un ronfleur ou pire, constaté des arrêts de la respiration pendant le sommeil de son compagnon de nuit? Outre l'aspect anecdotique et banal de ce symptôme, celui-ci peut masquer une autre pathologie beaucoup plus sérieuse, les apnées du sommeil. Les conséquences de ces apnées et de ces ronflements suscitent de nombreuses études depuis la généralisation des enregistrements du sommeil, en hospitalisation ou maintenant à domicile.
Au-delà de 40 ans, 60% des hommes et 40% des femmes ronflent un peu, épisodiquement. Mais seulement 25% des hommes et 15% des femmes souffrent d’un ronflement important pathologique, ou ronchopathie. Par ailleurs, dans nos pays occidentaux, 4 % de la population présente un syndrome plus grave, celui d'Apnées du Sommeil ou SAS. Cette population compte 75% d'hommes.
Anatomie et physiologie du ronflement et des apnées
Lors de la respiration, l'air passe librement par le nez et la bouche, descend dans le pharynx, passe derrière la base de la langue pour rejoindre le larynx, cartilage (pomme d'Adam) contenant les cordes vocales. Le larynx est fixé en haut de la trachée. C'est l'entrée qui mène l'air à l'intérieur des poumons.
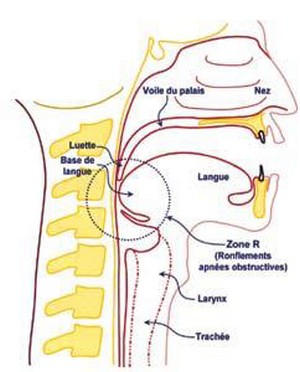
Coupe anatomique de profil
Au fond de la bouche, en arrière la langue, l'espace libre est relativement étroit. L'air doit passer entre la langue, le voile du palais, la luette et la paroi du pharynx. Lors du sommeil, les muscles sont relâchés, hypotoniques. Ils ont alors tendance à s'affaisser ce qui réduit encore le passage. Des conformations anatomiques individuelles, et la forme de la mâchoire inférieure, conditionnent le passage de l'air. Lorsque le voile du palais est long et épais, celui-ci réduit l'espace libre. (Zone R du schéma). Ces structures molles (paroi pharyngée, voile du palais, base de la langue) s'accolent l'une contre l'autre, et empêchent l'air de passer librement. Il se produit alors une vibration des tissus qui se traduit par le ronflement. Lorsque ce passage est trop réduit, la base de la langue crée un phénomène de soupape. Ce blocage empêche alors complètement l'air de pénétrer dans les poumons. Les efforts inspiratoires accentuent encore ce blocage, comme un bouchon placé à l'entrée de la trachée. C'est l'apnée obstructive. Après quelques inspirations inefficaces, un phénomène réflexe stimulera le système nerveux central qui déclenchera un réveil partiel. Cette stimulation redonne un peu de tonus aux muscles pharyngés qui se contractent et libèrent le passage. L'air pénètre à nouveau dans les poumons lors d'une grande inspiration, ample et souvent bruyante. Ce phénomène a tendance à se reproduire régulièrement durant la nuit.
Les facteurs anatomiques favorisant
Plusieurs facteurs sont susceptibles de provoquer le ronflement et des apnées obstructives. La conformation anatomique du massif facial, en particulier la longueur de la mâchoire inférieure, détermine la place de la langue dans la bouche. Ainsi, on trouvera beaucoup plus de ronfleurs et d'apnéïques chez les personnes ayant une mâchoire inférieure courte et rentrée. Un pharynx étroit, de grosses amygdales, une base langue volumineuse, peuvent réduire le passage de l'air. La surcharge pondérale est aussi un élément important. Le tissu graisseux, présent dans tous les organes, infiltre aussi la base de la langue. On considère habituellement qu'un kilogramme de poids du corps correspond à environ un gramme dans la base de la langue. Toute surcharge pondérale aura donc pour conséquence une augmentation de la base de la langue, ce qui réduit le passage du flux aérien.
L'association entre S.A.S. et ronflement
La quasi-totalité des patients (95%) ayant des apnées obstructives sont des ronfleurs. On peut considérer que le ronflement est un stade précurseur des apnées obstructives. Un bilan spécifique sera donc systématiquement demandé chez les gros ronfleurs.
Définition
L'individualisation du syndrome d'apnées obstructives du sommeil (SAOS) est relativement récente puisqu'elle remonte en 1976. Il reste que l'existence de troubles respiratoires nocturnes est connue depuis l'Antiquité et que Charles Dickens nous a laissé une description remarquable du tableau clinique, que le corps médical dénommera bien plus tard le " syndrome de Pickwick ". Les études épidémiologiques indiquent clairement qu'il s'agit d'une pathologie fréquente touchant 2 à 4% de la population adulte. Dans les centres d'études du sommeil, ce syndrome d'apnées est à l'origine de 43 à 59% des consultations pour hypersomnolence diurne et de 6 à 29% des consultations pour insomnie chronique. Encore insuffisamment reconnu, le SAOS se caractérise par la survenue répétitive d'apnées obstructives et d'hypopnées au cours du sommeil. La survenue de ces événements respiratoires nocturnes induit une importante désorganisation de la macrostructure comme de la micro architecture du sommeil. De part le retentissement sur la vigilance diurne de ces troubles du sommeil, le SAOS a un net impact sur la qualité de vie des patients. Tant les conséquences socioprofessionnelles des troubles de la vigilance que les fréquentes complications cardio- et cérébro-vasculaires du SAOS en font un véritable problème de santé publique.
DEFINITION
Le SAOS se définit par la survenue répétitive, au cours du sommeil, d'obstructions complètes ou partielles des voies aériennes supérieures, responsables d'apnées ou d'hypopnées.
- Une apnée est définie par l'arrêt du flux aérien durant plus de 10 secondes, cet arrêt pouvant être d'origine centrale (absence de commande respiratoire), obstructive (obstruction des voies aériennes supérieures avec persistance des efforts ventilatoires) ou mixte (c'est à dire d'origine centrale puis obstructive). Au cours des apnées obstructives, la contraction des muscles respiratoires est incapable de faire entrer l'air dans les poumons du fait de l'obstruction des voies aériennes supérieures. Les apnées peuvent s'accompagner de micro éveils.
- Il n'existe aucun consensus sur la définition des hypopnées. La recherche de la survenue d'hypopnées suppose une mesure quantitative, et non plus seulement qualitative, de la ventilation. A ce jour, la définition la plus utilisée est une diminution de la ventilation (du flux aérien) d'au moins 50 % pendant au moins 10 secondes, diminution associée à une désaturation artérielle en oxygène d'au moins 4%. Les hypopnées peuvent aussi s'accompagner de micro éveils.
- On calcule alors un index d'apnées-hypopnées, soit le nombre d'apnées et d'hypopnées par heure de sommeil :
IAH = (Nombre d'apnées + Nombre d'hypopnées) / Durée du Sommeil (mn) x 60
En fait, une valeur d'IAH n'a de sens que si elle est associée à des signes cliniques. La sévérité d'un SAOS ne peut se réduire à un index mais doit tenir compte de l'invalidité que représente l'hypersomnolence, de la souffrance physique et relationnelle des patients, des répercussions du syndrome sur le système cardio-respiratoire et sur le système nerveux.
Physiopathologie
Le SAOS est caractérisé par la répétition d'occlusions complètes (apnées) ou incomplètes (hypopnées) du pharynx. Cette région anatomique est complexe et est constituée de parois comportant des muqueuses, des muscles et des aponévroses. On remarque que le pharynx n'est constitué d'aucune structure rigide pour les soutenir et offre donc une grande susceptibilité à la déformation. Une anomalie des voies aériennes ou des muscles respiratoires peut n'entraîner aucun trouble pendant le jour grâce à des systèmes compensateurs, dont la perte pendant le sommeil peut favoriser l'apparition d'apnées.
CALIBRE ET FORME DES VOIES AÉRIENNES SUPÉRIEURES
A l'éveil, la forme des voies aériennes supérieures (VAS) est différente entre les sujets non ronfleurs, ronfleurs non apnéiques et apnéiques. L'augmentation de l'épaisseur des parois pharyngées latérales, des dépôts graisseux le long des parois pharyngées induisent une compression latérale des VAS. Toutes les anomalies morphologiques des VAS, comme une micrognathie, une rétrognathie, une hypertrophie de la base de la langue, favorisent et sont fréquemment associées à un SAOS. Il existe, en outre, une inflammation de la muqueuse des VAS chez les sujets apnéiques. Cette inflammation joue sur la collapsibilité des VAS par le biais d'une diminution de leur calibre lorsque le tonus vasculaire augmente. Des signes de souffrance musculaire à type de fibrose et d'dème ont également été décrits dans certains muscles des VAS. Ces anomalies sont de plus en plus marquées en fonction de l'importance des troubles respiratoires au cours du sommeil. De fait, elles témoignent des conséquences du traumatisme des VAS lié à la vibration tissulaire nocturne. Ces modifications tissulaires jouent elles-mêmes un rôle dans les propriétés mécaniques des tissus des VAS. L'élastance de la luette, reflet de la rigidité tissulaire, est plus élevée chez les patients apnéiques que chez les ronfleurs et ce, par dème, inflammation et fibrose des tissus péri musculaires associés à une plus grande proportion de tissu adipeux. Ainsi, l'index d'apnée augmente proportionnellement à l'élastance de la luette et, malgré une plus grande capacité à générer une tension des muscles dilatateurs des VAS chez le sujet apnéique (cf. infra), le déplacement tissulaire est moindre du fait d'une inefficacité de transmission de cette force dilatatrice aux tissus mous.
LES MUSCLES DILATATEURS DES VOIES AÉRIENNES SUPÉRIEURES
La contraction des muscles inspiratoires (essentiellement du diaphragme) crée une dépression négative, c'est à dire inférieure à la pression atmosphérique, ce qui attire l'air dans les poumons. Cette pression négative a tendance à fermer le conduit des VAS. Normalement, un mécanisme protecteur est mis en jeu avant même le début de l'inspiration par la contraction des muscles dilatateurs du pharynx. L'activité électromyographique phasique des muscles dilatateurs précède celle des muscles respiratoires. En outre, l'activité tonique des muscles oropharyngés est un élément important du maintien de la perméabilité des VAS, une diminution de cette activité tonique s'accompagnant d'une diminution de volume des VAS. En fait, toute modification de l'activité des muscles dilatateurs du pharynx va modifier la collapsibilité des VAS. Ainsi, les activités toniques et phasiques des muscles des VAS diminuent avec le sommeil, de façon variable d'un muscle à l'autre. Outre le sommeil, les muscles dilatateurs sont sensibles aux stimuli métaboliques (hypoxie, hypercapnie) et mécaniques (pression négative dans les VAS). Il faut noter à ce propos les effets délétères de l'alcool et de certains médicaments comme les benzodiazépines qui dépriment l'activité des muscles pharyngés. Mais, il apparaît, en fait, que l'activité du muscle génioglosse est plus élevée chez les patients apnéiques que chez les sujets normaux à l'endormissement, au cours du sommeil mais surtout à l'éveil. Les caractéristiques histochimiques et métaboliques des fibres musculaires des muscles pharyngés et laryngés varient entre les sujets apnéiques et ronfleurs simples, l'ensemble des muscles pharyngés et laryngés des sujets ronfleurs et apnéiques semblant faire face à une adaptation physiologique en réponse à un exercice de type résistif répété supra maximal prolongé : hypertrophie musculaire - augmentation de la proportion des fibres IIA à contraction rapide – augmentation des activités enzymatiques de la voie anaérobique ... On ne peut donc pas invoquer une simple diminution de l'activité des muscles dilatateurs oropharyngés dans le sommeil pour expliquer l'obstruction des VAS dans le SAOS.
IRRÉGULARITÉS RESPIRATOIRES DANS LE SOMMEIL ET DÉCLENCHEMENT DES APNÉES
Plusieurs arguments supportent actuellement l'hypothèse que les irrégularités respiratoires, telles que l'alternance d'hypo et d'hyperventilations, sont en fait à l'origine des apnées obstructives :
- Celles-ci sont presque exclusivement observées dans le sommeil lent léger et au cours du sommeil paradoxal, où il existe des fluctuations physiologiques de la ventilation mais pratiquement jamais au cours du sommeil lent profond, où la respiration est très stable et régulière.
- La respiration au cours du sommeil reste périodique après trachéotomie chez les patients porteurs d'un SAOS.
- L'induction de phénomènes de respiration périodique dans le sommeil s'accompagne d'obstructions des VAS chez l'homme normal...
Il existe, de fait, au cours des périodes d'hypoventilation, une baisse de l'activité des muscles oropharyngés comme un retard d'activation de ces muscles par rapport aux muscles respiratoires – retard de contraction des muscles dilatateurs observé dans la majorité des apnées obstructives. L'origine d'une telle instabilité respiratoire chez le patient apnéique reste à élucider, l'augmentation des résistances des VAS pouvant elle-même induire une instabilité respiratoire.
Epidémiologie
Dans la plupart des études récentes se basant sur un IAH > 15 dans des groupes d'âge moyen, la prévalence du SAOS est comprise entre 4 et 25%. Cependant, la fréquence réelle du SAOS n'est pas connue avec certitude car aucun échantillon représentatif de la population générale n'a bénéficié d'une polysomnographie de dépistage.
FACTEURS JOUANT SUR LA PRÉVALENCE DU SAOS
La prévalence du SAOS augmente nettement avec l'âge et ce, surtout après 60 ans.
Dès les premières études, il est apparue une nette prédominance masculine. Le rôle des hormones sexuelles est confirmée par l'augmentation de la prévalence des troubles respiratoires nocturnes chez la femme après la ménopause. L'administration d'hormones mâles provoque l'aggravation d'un SAOS chez l'homme et l'apparition d'un SAOS chez la femme.
La grande fréquence des obèses parmi les patients atteints de SAOS est une notion classique. Le rôle de l'obésité, essentiellement l'obésité tronculaire (ou androïde), est confirmé par la diminution de l'IAH après une perte de poids.
Il existe également une association nette entre SAOS et ronflements.
Une relation entre la prévalence des apnées nocturnes observées par l'entourage et la consommation d'alcool a été retrouvée chez les hommes dans une enquête de terrain récente. La plupart des auteurs penchent pour un effet direct de l'alcool sur les muscles dilatateurs du pharynx.
En concordance avec une association tabagisme ronflements, on retrouve une proportion significativement plus élevée de SAOS chez les fumeurs. Après ajustement sur l'âge, le poids, la consommation de café et d'alcool, le risque relatif est 3 fois plus élevé chez les fumeurs.
Il existe une prévalence très élevée des anomalies ORL chez les patients atteints de SAOS - surtout l'obstruction nasale.
Certaines études arguent en faveur de l'existence d'un facteur génétique, trouvant une prévalence exceptionnellement élevée (47%) de troubles respiratoires nocturnes chez les fils de 45 patients présentant un SAOS. Des familles présentant plusieurs patients atteints d'un SAS ont été décrites dans la littérature. Cette ségrégation familiale s'explique par le fait que la plupart des facteurs de risques impliqués dans la physiopathologie des SAS sont largement déterminés génétiquement (obésité, alcoolisme, facteurs anatomiques osseux et des tissus mous qui prédisposent à l'obstruction des voies aériennes supérieures).
Des différences de configuration anatomique des voies aériennes supérieures laissent supposer une influence ethnique sur la survenue d'un SAOS. Il existe un risque 2 fois plus important de troubles respiratoires nocturnes chez les Américains d'origine africaine comparativement aux Américains d'origine caucasienne. Les sujets d'origine africaine présentent des troubles respiratoires nocturnes en moyenne 8,4 ans plus tôt que les patients d'origine caucasienne.
Certaines pathologies endocrines, enfin, sont fréquemment associées à un SAOS, comme l'acromégalie, le syndrome de Cushing ou, surtout, une hypothyroïdie et un diabète.
L'administration de certains médicaments comme les benzodiazépines (somnifères, anxiolytiques ..) et les bêtabloquants aggravent un SAOS.
SAOS, MORBIDITÉ ET MORTALITÉ
La mortalité des SAOS est essentiellement d'origine vasculaire.
Au plan de la morbidité, les risques relatifs comparés à des sujets normaux de même âge sont de 2 fois plus d'hypertension artérielle (HTA), 3 fois plus d'insuffisance coronarienne et 4 fois plus d'accidents vasculaires cérébraux.
L'influence du SAOS seul sur la mortalité reste cependant controversée et d'une grande actualité. Une première étude portant sur 20 sujets âgés ne constate aucune différence due à la présence d'événements respiratoires nocturnes dans les taux de morbidité et de mortalité. A l'opposé, d'autres auteurs trouvent, sur 385 sujets masculins suivis pendant 8 ans, une probabilité de survie cumulée nettement diminuée chez les patients ayant un IA > 20 (0,63) comparativement à celle (0,96) des patients avec un IA < 20 et ce, surtout pour les sujets âgés de moins de 50 ans. Une étude rapporte une mortalité triple chez les sujets âgés avec un IA > 10. Une étude récente portant sur 1620 patients avec SAOS montre un excès de mortalité pour les hommes de 40 à 60 ans et souligne le rôle délétère de l'obésité et de l'hypertension. Une étude rétrospective portant sur 3 100 hommes âgés de 30 à 69 ans a étudié la mortalité associée au ronflement et à la somnolence diurne excessive sur une période de 10 ans : une augmentation de mortalité (RR = 2,7) a été retrouvée chez les sujets de moins de 60 ans souffrant de ronchopathie et d'hypersomnolence diurne.
SAOS ET QUALITÉ DE VIE - SAOS ET SANTÉ PUBLIQUE
L'hypoxémie nocturne due à la survenue répétitive des apnées a des conséquences à long terme (HTA, polyglobulie, vieillissement cérébral). Les nombreux micro éveils nocturnes induits par les apnées, si ils sont au départ " protecteurs ", entraînent une importante fragmentation du sommeil elle-même à l'origine de profonds troubles de la vigilance diurne. Apparaissent des troubles de l'attention et de la mémoire, une irritabilité, une certaine morosité voire un syndrome dépressif avec une détérioration des rapports familiaux et professionnels. Au plan social, les conséquences les plus graves de cette hypersomnolence diurne restent la survenue d'endormissements au volant produisant des accidents de la circulation. Aujourd'hui, les pathologies du sommeil et les troubles de la vigilance sont inscrites parmi les affections susceptibles de donner lieu à la délivrance d'un permis de conduire de durée de validité limitée (Journal Officiel du 29 Mai 1997).
Il existe, de fait, une augmentation de la consommation des ressources de santé chez les patients porteurs d'un SAOS. En outre, ces patients représentent un danger tant sur les routes que sur leur lieu de travail, majoré par le fait que tant les malades que le corps médical négligent le syndrome. Pour les pouvoirs publics, le SAOS pose des problèmes de coût : coût du diagnostic – essentiellement de la polysomnographie, coût du traitement à long terme - essentiellement de la pression positive continue (PPC). On peut espérer qu'un diagnostic précoce et un traitement efficace préviendront la survenue des complications et que l'on parviendra à trouver des procédures diagnostiques plus simples et moins coûteuses.
Page 1 sur 2
